我國醫(yī)療器械與制藥行業(yè)與發(fā)達(dá)國家的差距及其原因分析

中國醫(yī)療器械和制藥行業(yè),特別是生物制藥領(lǐng)域,長期以來與發(fā)達(dá)國家存在顯著差距。這種差距主要體現(xiàn)在研發(fā)投入、技術(shù)積累、產(chǎn)業(yè)鏈配套、監(jiān)管體系和國際化程度等多個方面。
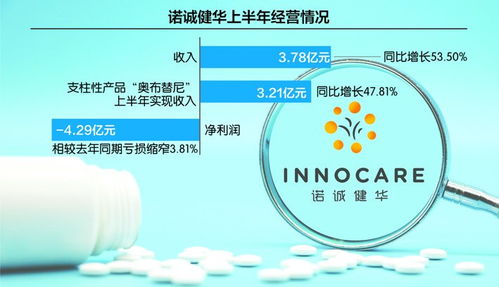
研發(fā)投入和技術(shù)積累是核心因素。發(fā)達(dá)國家如美國、德國和日本,在生物制藥和高端醫(yī)療器械領(lǐng)域擁有數(shù)十年的技術(shù)沉淀,年均研發(fā)投入占銷售收入的15%以上。相比之下,我國企業(yè)研發(fā)投入比例較低,平均不足10%,且基礎(chǔ)研究薄弱,原創(chuàng)性技術(shù)突破較少。例如,在單克隆抗體、基因治療等前沿領(lǐng)域,我國仍以仿制和改進(jìn)為主,核心專利大多被跨國企業(yè)掌握。
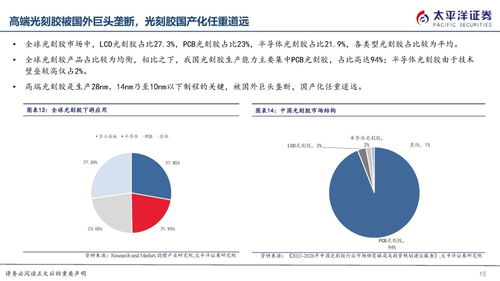
產(chǎn)業(yè)鏈配套不完善制約了行業(yè)發(fā)展。高端醫(yī)療器械和生物制藥依賴精密的原材料、設(shè)備和生產(chǎn)工藝。發(fā)達(dá)國家已形成完整的產(chǎn)業(yè)鏈,從上游的試劑、生物反應(yīng)器到下游的純化技術(shù),均有專業(yè)化企業(yè)支撐。而我國在關(guān)鍵設(shè)備(如生物反應(yīng)器、層析系統(tǒng))和核心原材料(如細(xì)胞培養(yǎng)基、色譜填料)方面仍高度依賴進(jìn)口,導(dǎo)致生產(chǎn)成本高且供應(yīng)鏈穩(wěn)定性不足。
第三,監(jiān)管和審批體系差異顯著。發(fā)達(dá)國家如美國FDA和歐洲EMA建立了成熟、高效的審評機(jī)制,鼓勵創(chuàng)新并加速產(chǎn)品上市。我國藥品審評審批制度雖在近年來大幅改革,但歷史積壓問題、審評資源不足及標(biāo)準(zhǔn)與國際接軌程度有限,仍延緩了創(chuàng)新產(chǎn)品的落地。知識產(chǎn)權(quán)保護(hù)力度不足,也削弱了企業(yè)長期投入研發(fā)的動力。
第四,人才和國際化水平存在差距。發(fā)達(dá)國家匯聚了全球頂尖的生物醫(yī)藥人才,并擁有完善的產(chǎn)學(xué)研合作機(jī)制。我國高端人才儲備不足,且企業(yè)與高校、科研院所的協(xié)同創(chuàng)新機(jī)制尚不成熟。同時(shí),我國制藥企業(yè)國際化程度較低,海外市場準(zhǔn)入和品牌影響力有限,難以與跨國巨頭競爭。
近年來我國政府已意識到這些問題,并通過'健康中國2030'規(guī)劃、加大創(chuàng)新藥政策支持、設(shè)立生物醫(yī)藥產(chǎn)業(yè)基金等措施積極追趕。隨著資本投入增加、人才回流加速以及監(jiān)管優(yōu)化,我國醫(yī)療器械和制藥行業(yè)有望逐步縮小與發(fā)達(dá)國家的差距。未來,聚焦原創(chuàng)研發(fā)、強(qiáng)化產(chǎn)業(yè)鏈自主可控、深化國際合作將是關(guān)鍵突破點(diǎn)。
如若轉(zhuǎn)載,請注明出處:http://www.liangdianbaike.cn/product/36.html
更新時(shí)間:2026-01-09 17:23:57